諾貝爾醫學獎-癌症免疫療法

辨識免疫系統訊號 抑制及重點攻擊腫瘤
2018年諾貝爾生理學或醫學獎,由美國德州大學安德森癌症中心(The University of Texas M. D. Anderson Cancer Center, UT MDA)的艾利森(James P. Allison)與日本京都大學(Kyoto University)的本庶佑(Tasuku Honjo)同享 殊榮,得獎的原因為發明「透過抑制負向調控免疫功能運作的癌症免疫療法」。
免疫檢查點
免疫系統的功能主要是保護人體免受外來微生物的侵襲,關鍵過程在於如何辨識與區分「自我」與「非自我」分子,進而促成重要的T淋巴細胞活化。而T細胞活化過程則仰賴抗原呈現細胞(antigen presenting cells),將抗原消化再重新組裝成讓T細胞可以識別的型態,並受到T細胞和抗原呈現細胞上分子的精密調控,而這些分子即稱為免疫檢查點(immune checkpoint)。

在這些分子中,有些會促進T細胞活化,刺激免疫反應的發生,以確保免疫系統足以對抗入侵的病原體;有些則會抑制活化訊號,扮演抑制角色、避免免疫系統過度活化而造成組織傷害之虞。事實上,免疫檢查點常被視為免疫系統中抑制型的調控分子,在免疫反應發生時傳遞抑制訊號,以避免或減少組織損傷,維持不影響自身組織細胞的自我耐受性(self-tolerance)。
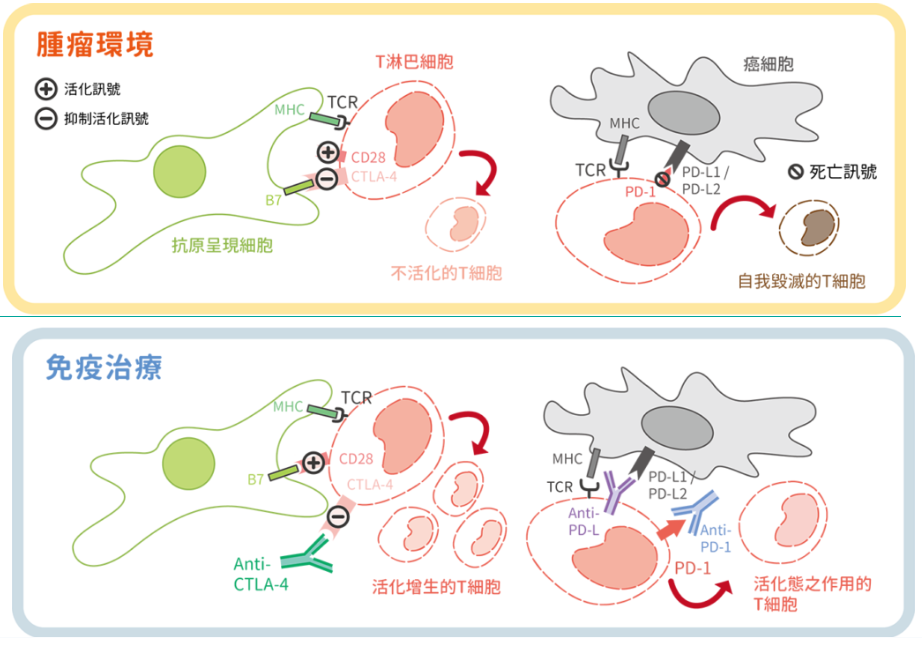
圖一:在腫瘤環境及免疫檢查點療法中,參與抗腫瘤免疫的T細胞的示意圖。顯示T細胞上CD28、CTLA-4和PD-1與抗原呈現細胞和腫瘤上的配體之間的相互作用。在CTLA-4抗體和PD-1(PD-L1)抗體存在下,抑制T細胞活化的信號被 阻斷,而反過來增強T細胞活化並隨後增強抗腫瘤的免疫反應。
1995年,艾利森研究發現了細胞毒性T淋巴細胞抗原4(cytotoxic T-lymphocyte-associated protein 4, CTLA-4)可抑制T細胞活化,並證明CTLA-4的抗體可以阻斷抑制T細胞活化的訊息傳遞,導致T細胞活化並進行癌細胞的毒殺。本庶佑教授則於1992年發現計畫性死亡蛋白質-1(programmed cell death protein 1, PD-1)位於T細胞上,當其訊息傳遞時會誘發程序性的細胞死亡反應,並證實其在腫瘤逃避毒殺機制上扮演著關鍵角色。上述兩者的抗體藥物陸續被研發,並經臨床試驗證明單一或合併使用抗CTLA-4抗體及抗PD-1抗體可殺死癌細胞,能治療癌症並顯著延長部分患者的生命。 2人也因引領癌症治療進入全新紀元,曾於2014年獲得由尹衍樑博士所設立的第一屆唐獎(Tang Prize)生技醫藥獎。